| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | ||||
| 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 25 | 26 | 27 | 28 | 29 | 30 | 31 |
- laue
- X선 기초
- 전기장이 가해진
- 재료과학
- 결정립
- 에디슨의 패배
- 그루데 이론
- 라만 분석
- 라만 현상
- drude
- Raman
- 분해전단응력
- 3 o'clock things
- 일상
- 라만 분석기
- 결정구조학
- 에너지 역학
- 특성스펙트럼
- X선
- X선의 발견
- 슬립계
- X선 공학
- 화합물 반도체
- 륀트겐
- von laue
- 빛의 손실
- 전자의 속도
- 흡광
- 연속스펙트럼
- 재료열역학
- Today
- Total
공머생의 공부노트
전기화학과 수용액 본문
전기화학은 전기적 효과와 화학적 효과의 상호작용에 중점을 둔 학문으로 주로 전자의 이동에 의해 생기는 에너지 변환이나 생성물 발생에 중점을 둔다.
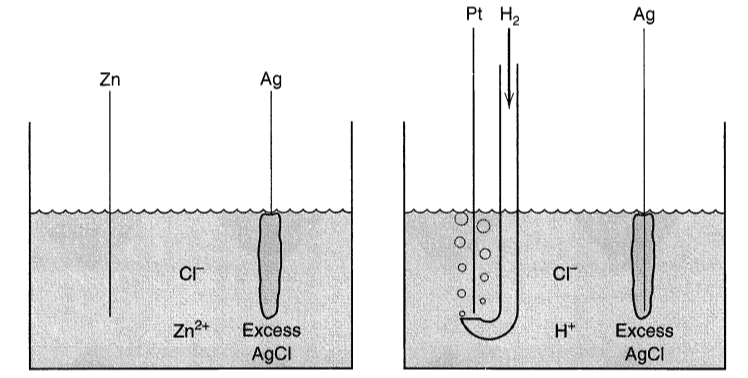
즉 전자에 의해 어떤 화합물은 더 높은 에너지로 충전되기도 하고 방전되기도 하며 변화할 수 있고 이러한 변화를 만들어 내는 것은 대부분 전위차 (Potencial)에 의한 것이다. 태양전지, 배터리, 수전해 장비 등 현대에 중요하게 생각되는 화학장비들 대부분이 전기화학에 그 기초를 두고있다.
1. 용액 속 이온과 전해질
우리가 화학 상들의 사이의 계면을 고려할때 주의해서 봐야하는 것은 전자가 어디서 어디로 이동하는지, 어떤 물질이 이전자를 받아서 무엇으로 바뀌는지에 대한 것이다.
우선 전자가 이동하는 것에 대해 생각해보자.

대부분의 전기화학 실험과 반응은 물 속에서 진행되는데, 이를 수계(aqueous)에서 진행된다고 표현한다. (반대로 비수계에서 진행되는 경우도 많고 물이 아예 없는 경우도 당연히 있다).
그런데 만약 여러분이 이런 전기분해를 오른쪽 그림처럼 이온이 없는 물에서만 진행한다면 당연하게도 전기분해는 일어나지 않으며 전구에 불이 들어오지 않는다.
이처럼 물 속에서 전하를 이동시킬수 있는 Na, Cl 같은 원소들을 이온(ion)이라고 하며 이런 이온이 존재하는 물을 전해질 (electrolytes) 이라고 한다.

수전해 실험에서는 주로 KOH, Na2SO4, H2SO4, HCIO4 등의 전해질을 주로 사용하며, 수계가 아닌경우 DMSO, NMP등의 수용액이 주로 사용된다.
'연구 분석법 > 전기화학' 카테고리의 다른 글
| 임피던스_임피던스 해석법 (0) | 2024.07.27 |
|---|---|
| 임피던스_RC병렬회로의 임피던스 유도 (0) | 2024.07.27 |
| 임피던스_임피던스의 정의와 유도 (0) | 2024.07.27 |
| 임피던스_각 요소의 물리적 의미 (0) | 2024.07.27 |
| 전기화학 셀 및 반응 원리 (0) | 2022.01.27 |




